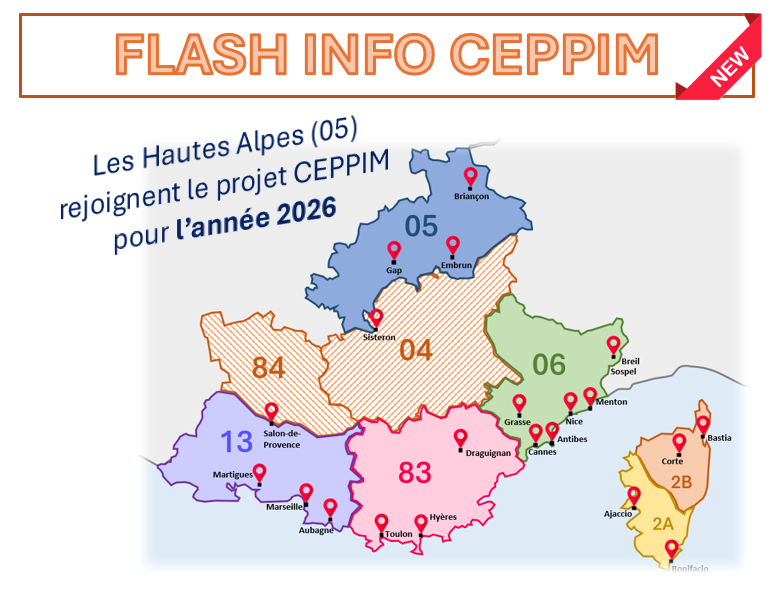
∴ À LA UNE ∴
∴ Pertinence, efficience et régulation de l’offre de soins ∴
Le Directeur Général de l’ARS arrête les objectifs régionaux relatifs aux produits de santé conformément aux objectifs nationaux.
Ces objectifs sont déclinés en programme d’actions avec les modalités de mise en œuvre et les indicateurs de suivi.
L’OMéDIT PACA-Corse participe notamment à l’élaboration et à l’analyse des rapports annuels d’évaluation relatifs aux produits de santé, conformément à ses missions.
∴ ACTIVITéS ET THÉMATIQUES ∴
Bon usage des produits de santé
Activités et bon usage
Activités de prévention
Autres thématiques
∴ COMITéS TECHNIQUES RéGIONAUX / INTERRéGIONAUX ∴
Pour ses travaux, l’OMéDIT est assisté de groupes techniques, d’envergure régionale et/ou interrégionale PACA et Corse, dédiés à des thématiques précises. Chacun de ces groupes est administré préférentiellement par un membre de la cellule de coordination de l’OMéDIT.
Chaque groupe établit son programme de travail en fonction des missions qui lui sont confiées.
Les membres de chacun de ces groupes techniques régionaux sont des professionnels reconnus pour leurs compétences sur la thématique traitée.
La durée du mandat varie selon les groupes techniques constitués.
Les réunions de ces groupes techniques régionaux ont lieu autant que de besoins et font l’objet de compte-rendus rédigés par son animateur référent (avec l’aide du membre de la cellule de coordination) et soumis aux membres pour validation.
Les animateurs référents des groupes techniques peuvent être sollicités ponctuellement pour présenter la synthèse de leurs travaux lors des réunions régionales ou interrégionales.
Les documents sont disponibles dans les différentes rubriques ci-dessous.
∴ L’OMéDIT PACA-CORSE ∴
CONTEXTE
L’article R. 1413-90 du code de la santé publique dispose qu’un Observatoire du Médicament, des Dispositifs médicaux et de l’Innovation Thérapeutique (OMéDIT) régional ou interrégional soit constitué auprès des agences régionales de santé (ARS).
« OMéDIT » est la nouvelle appellation de l’Observatoire du Médicament, et de l’Innovation Thérapeutique (OMIT), crée en 2000 par le directeur de l’Agence Régionale de l’Hospitalisation PACA, à l’initiative du Professeur Jean-Paul CANO qui est à l’origine du premier observatoire en France. C’est en 2005, qu’a été introduite la mise en œuvre des Observatoires Régionaux ou interrégionaux du Médicament et des Dispositifs médicaux stériles, appelés communément OMéDIT.
L’OMéDIT PACA-Corse est une structure interrégionale d’appui aux professionnels, d’évaluation et d’expertise scientifique et médico-économique placée auprès des Agence Régionale de Santé PACA et Corse. Elle est chargée d’animer une politique de coordination autour du bon usage des produits de santé et de promouvoir les bonnes pratiques en termes de qualité, sécurité et d’efficience des soins. Elle a pour objectif d’éclairer et de conduire les travaux nécessaires à la mise en œuvre de la politique régionale des produits de santé (médicaments, dispositifs médicaux et thérapeutiques innovantes) : analyse pharmaco- et médico-économiques, sécurisation des circuits, bon usage et lutte contre l’iatrogénie, pertinence et suivi des pratiques des produits de santé, etc…
Le décret n° 2017-1483 du 18 octobre 2017 relatif aux observatoires du médicament, des dispositifs médicaux et de l’innovation thérapeutique a pour objet d’adapter les missions des observatoires aux évolutions résultant de la mise en place des contrats d’amélioration de la qualité et de l’efficience des soins (CAQES) et des réseaux régionaux de vigilances et d’appui (RREVA).
Les champs d’actions des OMéDIT sont les établissements de santé (ES), les établissements et services médico-sociaux (ESMS) et tout professionnel de santé, quels que soient ses lieux et modes d’exercice.
L’OMéDIT est agréé comme terrain de stage pour les internes en pharmacie (hors domaine). Chaque site de l’OMéDIT peut accueillir un interne en pharmacie, les fiches de postes pour chacun des sites sont disponibles ici : site PACA & site Corse.
OBJECTIFS
Les objectifs des OMéDIT sont d’améliorer la qualité, la sécurité et la pertinence de l’usage des médicaments et des produits et prestations, mais aussi de contribuer à la lutte contre l’iatrogénie.
Les missions des OMéDIT sont les suivantes :
– appui à l’élaboration des CAQES
– analyse des rapports annuels d’évaluation
– accompagnement des ES pour l’amélioration des résultats par rapport aux objectifs dudit contrat
– expertise médico-économique et suivi et analyse des prescriptions, dispensations et utilisations des médicaments, des produits et des prestations observés au niveau régional
– mise à disposition d’informations, de formations et d’outils adaptés pour les structures et les professionnels de santé
– organisation d’échanges réguliers sur les pratiques relatives à l’usage des médicaments, des produits et prestations
– participation aux travaux du Réseau Régional de Vigilances et d’Appui
– gestion des évènements indésirables graves associés à des soins, à la demande de l’ARS si les produits de santé sont concernés.
L’ÉQUIPE
Pr. STÉPHANE HONORÉ
Pharmacien responsable
04 13 55 81 87 / 06 85 30 16 85

Dr. CLAUDINE GARD
Pharmacien (site ARS Corse)
04 95 51 98 56 / 07 61 46 33 39

∴ NOUS CONTACTER ∴
OMéDIT PACA-CORSE
Agence Régionale de Santé PACA
132 Boulevard de PARIS
13003 MARSEILLE
OMEDIT-PACA-CORSE@sante.gouv.fr